Definisi dari Kalor adalah suatu energi yang mudah diterima dan mudah sekali dilepaskan sehingga dapat mengubah temperatur zat tersebut menjadi naik atau turun.
Pengertian suhu
Suhu adalah besaran yang menyatakan derajat panas dingin suatu benda dan alat yang digunakan untuk mengukur suhu adalah thermometer. Dalam kehidupan sehari-hari masyarakat untuk mengukur suhu cenderung menggunakan indera peraba. Tetapi dengan adanya perkembangan teknologi maka diciptakanlah termometer untuk mengukur suhu dengan valid.
Pada abad 17 terdapat 30 jenis skala yang membuat para ilmuan kebingungan. Hal ini memberikan inspirasi pada Anders Celcius (1701 – 1744) sehingga pada tahun 1742 dia memperkenalkan skala yang digunakan sebagai pedoman pengukuran suhu. Skala ini diberinama sesuai dengan namanya yaitu Skala Celcius. Apabila benda didinginkan terus maka suhunya akan semakin dingin dan partikelnya akan berhenti bergerak, kondisi ini disebut kondisi nol mutlak. Skala Celcius tidak bisa menjawab masalah ini maka Lord Kelvin (1842 – 1907) menawarkan skala baru yang diberi nama Kelvin. Skala kelvin dimulai dari 273 K ketika air membeku dan 373 K ketika air mendidih. Sehingga nol mutlak sama dengan 0 K atau -273°C. Selain skala tersebut ada juga skala Reamur dan Fahrenheit. Untuk skala Reamur air membeku pada suhu 0°R dan mendidih pada suhu 80°R sedangkan pada skala Fahrenheit air membuka pada suhu 32°F dan mendidih pada suhu 212°F.
Berikut ini perbandingan skala dari termometer diatas
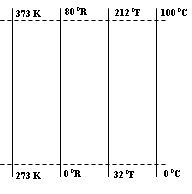
Yang menjadi masalah dalam bab suhu adalah kebanyakan orang kesulitan untuk mengubah dari satu skala ke skala yang lainnya. Berikut ini adalah contoh mengubah dari skala celcius ke skala fahrenheit

Untuk skala yang lain caranya sama dengan contoh diatas. Thermometer menurut isinya dibagi menjadi : termometer cair, termometer padat, termometer digital. Semua termometer ini mempunyai keunggulan dan kelemahan masing-masing. Sedangkan berdasarkan penggunaannya termometer bermacam-macam sebagai misal termometer klinis, termometer lab dan lain-lain.
Berikut ini pembahasan macam macam termometer.
Pembuatan termometer pertama kali dipelopori oleh Galileo Galilei (1564 – 1642) pada tahun 1595. Alat tersebut disebut dengan termoskop yang berupa labu kosong yang dilengkapi pipa panjang dengan ujung pipa terbuka. Mula-mula dipanaskan sehingga udara dalam labu mengembang. Ujung pipa yang terbuka kemudian dicelupkan kedalam cairan berwarna. Ketika udara dalam tabu menyusut, zat cair masuk kedalam pipa tetapi tidak sampai labu. Beginilah cara kerja termoskop. Untuk suhu yang berbeda, tinggi kolom zat cair di dalam pipa juga berbeda. Tinggi kolom ini digunakan untuk menentukan suhu. Prinsip kerja termometer buatan Galileo berdasarkan pada perubahan volume gas dalam labu. Tetapi dimasa ini termometer yang sering digunakan terbuat dari bahan cair misalnya raksa dan alkhohol. Prinsip yang digunakan adalah pemuaian zat cair ketika terjadi peningkatan suhu benda.
Raksa digunakan sebagai pengisi termometer karena raksa mempunyai keunggulan :
Termometer ini menggunakan cairan raksa atau alkhohol. Jika cairan bertambah panas maka raksa atau alkhohol akan memuai sehingga skala nya bertambah. Agar termometer sensitif terhadap suhu maka ukuran pipa harus dibuat kecil (pipa kapiler) dan agar peka terhadap perubahan suhu maka dinding termometer (reservoir) dibuat setipis mungkin dan bila memungkinkan dibuat dari bahan yang konduktor.
Termometer Klinis
Termometer ini khusus digunakan untuk mendiaknosa penyakit dan bisanya diisi dengan raksa atau alkhohol. Termometer ini mempunyai lekukan sempit diatas wadahnya yang berfungsi untuk menjaga supaya suhu yang ditunjukkan setelah pengukuran tidak berubah setelah termometer diangkat dari badan pasien. Skala pada termometer ini antara 35°C sampai 42°C.
Termometer Ruangan
Termometer ini berfungsi untuk mengukur suhu pada sebuah ruangan. Pada dasarnya termometer ini sama dengan termometer yang lain hanya saja skalanya yang berbeda. Skala termometer ini antara -50°C sampai 50°C
Termometer Digital
Karena perkembangan teknologi maka diciptakanlah termometer digital yang prinsip kerjanya sama dengan termometer yang lainnya yaitu pemuaian. Pada termometer digital menggunakan logam sebagai sensor suhunya yang kemudian memuai dan pemuaiannya ini diterjemahkan oleh rangkaian elektronik dan ditampilkan dalam bentuk angka yang langsung bisa dibaca.
Termokopel
Merupakan termometer yang menggunakan bahan bimetal sebagai alat pokoknya. Ketika terkena panas maka bimetal akan bengkok ke arah yang koefesiennya lebih kecil. Pemuaian ini kemudian dihubungkan dengan jarum dan menunjukkan angka tertentu. Angka yang ditunjukkan jarum ini menunjukkan suhu benda
Perbandingan 4 skala termometer

......


 dengan
dengan
Suhu adalah besaran yang menyatakan derajat panas dingin suatu benda dan alat yang digunakan untuk mengukur suhu adalah thermometer. Dalam kehidupan sehari-hari masyarakat untuk mengukur suhu cenderung menggunakan indera peraba. Tetapi dengan adanya perkembangan teknologi maka diciptakanlah termometer untuk mengukur suhu dengan valid.
Pada abad 17 terdapat 30 jenis skala yang membuat para ilmuan kebingungan. Hal ini memberikan inspirasi pada Anders Celcius (1701 – 1744) sehingga pada tahun 1742 dia memperkenalkan skala yang digunakan sebagai pedoman pengukuran suhu. Skala ini diberinama sesuai dengan namanya yaitu Skala Celcius. Apabila benda didinginkan terus maka suhunya akan semakin dingin dan partikelnya akan berhenti bergerak, kondisi ini disebut kondisi nol mutlak. Skala Celcius tidak bisa menjawab masalah ini maka Lord Kelvin (1842 – 1907) menawarkan skala baru yang diberi nama Kelvin. Skala kelvin dimulai dari 273 K ketika air membeku dan 373 K ketika air mendidih. Sehingga nol mutlak sama dengan 0 K atau -273°C. Selain skala tersebut ada juga skala Reamur dan Fahrenheit. Untuk skala Reamur air membeku pada suhu 0°R dan mendidih pada suhu 80°R sedangkan pada skala Fahrenheit air membuka pada suhu 32°F dan mendidih pada suhu 212°F.
Berikut ini perbandingan skala dari termometer diatas

Yang menjadi masalah dalam bab suhu adalah kebanyakan orang kesulitan untuk mengubah dari satu skala ke skala yang lainnya. Berikut ini adalah contoh mengubah dari skala celcius ke skala fahrenheit

Untuk skala yang lain caranya sama dengan contoh diatas. Thermometer menurut isinya dibagi menjadi : termometer cair, termometer padat, termometer digital. Semua termometer ini mempunyai keunggulan dan kelemahan masing-masing. Sedangkan berdasarkan penggunaannya termometer bermacam-macam sebagai misal termometer klinis, termometer lab dan lain-lain.
Berikut ini pembahasan macam macam termometer.
Pembuatan termometer pertama kali dipelopori oleh Galileo Galilei (1564 – 1642) pada tahun 1595. Alat tersebut disebut dengan termoskop yang berupa labu kosong yang dilengkapi pipa panjang dengan ujung pipa terbuka. Mula-mula dipanaskan sehingga udara dalam labu mengembang. Ujung pipa yang terbuka kemudian dicelupkan kedalam cairan berwarna. Ketika udara dalam tabu menyusut, zat cair masuk kedalam pipa tetapi tidak sampai labu. Beginilah cara kerja termoskop. Untuk suhu yang berbeda, tinggi kolom zat cair di dalam pipa juga berbeda. Tinggi kolom ini digunakan untuk menentukan suhu. Prinsip kerja termometer buatan Galileo berdasarkan pada perubahan volume gas dalam labu. Tetapi dimasa ini termometer yang sering digunakan terbuat dari bahan cair misalnya raksa dan alkhohol. Prinsip yang digunakan adalah pemuaian zat cair ketika terjadi peningkatan suhu benda.
Raksa digunakan sebagai pengisi termometer karena raksa mempunyai keunggulan :
- raksa penghantar panas yang baik
- pemuaiannya teratur
- titik didihnya tinggi
- warnanya mengkilap
- tidak membasahi dinding
- titik bekunya rendah
- harganya murah
- pemuaiannya 6 kali lebih besar dari pada raksa sehingga pengukuran mudah diamati
Termometer ini menggunakan cairan raksa atau alkhohol. Jika cairan bertambah panas maka raksa atau alkhohol akan memuai sehingga skala nya bertambah. Agar termometer sensitif terhadap suhu maka ukuran pipa harus dibuat kecil (pipa kapiler) dan agar peka terhadap perubahan suhu maka dinding termometer (reservoir) dibuat setipis mungkin dan bila memungkinkan dibuat dari bahan yang konduktor.
Termometer Klinis
Termometer ini khusus digunakan untuk mendiaknosa penyakit dan bisanya diisi dengan raksa atau alkhohol. Termometer ini mempunyai lekukan sempit diatas wadahnya yang berfungsi untuk menjaga supaya suhu yang ditunjukkan setelah pengukuran tidak berubah setelah termometer diangkat dari badan pasien. Skala pada termometer ini antara 35°C sampai 42°C.
Termometer Ruangan
Termometer ini berfungsi untuk mengukur suhu pada sebuah ruangan. Pada dasarnya termometer ini sama dengan termometer yang lain hanya saja skalanya yang berbeda. Skala termometer ini antara -50°C sampai 50°C
Termometer Digital
Karena perkembangan teknologi maka diciptakanlah termometer digital yang prinsip kerjanya sama dengan termometer yang lainnya yaitu pemuaian. Pada termometer digital menggunakan logam sebagai sensor suhunya yang kemudian memuai dan pemuaiannya ini diterjemahkan oleh rangkaian elektronik dan ditampilkan dalam bentuk angka yang langsung bisa dibaca.
Termokopel
Merupakan termometer yang menggunakan bahan bimetal sebagai alat pokoknya. Ketika terkena panas maka bimetal akan bengkok ke arah yang koefesiennya lebih kecil. Pemuaian ini kemudian dihubungkan dengan jarum dan menunjukkan angka tertentu. Angka yang ditunjukkan jarum ini menunjukkan suhu benda
Perbandingan 4 skala termometer

......
Hukum Boyle (kadang kala dirujuk sebagai Hukum Boyle-Mariotte) adalah satu daripada beberapa hukum gas dan kes khusus bagi hukum gas ideal ("ideal gas law). Hukum Boyle menggambarkan hubungkait kadar songsang antara tekanan dan isipadu mutlak gas, jika suhu dikekalkan sekata dalam sistem tertutup.[1][2] Hukum ini dinamakan sempena ahli kimia dan fizik Robert Boyle, yang menerbitkan hukum asal pada tahun 1662.[3] Hukum itu boleh dinyatakan seperti berikut:
Bagi jumlah tetap gas ideal dikekalkan pada suhu tetap, P [tekanan - "pressure"] dan V [Isipadu - volume] adalah berkadar songsang (ketika satu meningkat, yang lain menurun).[2]
Sejarah
Hukum Boyle merupakan salah satu dari hukum gas. Hukum ini pertama kali disarankan dalam tahun 1662 oleh Robert Boyle yang bertindak balas terhadap cadangan oleh penolongnya John Townley, menjelaskan bahawa pada suhu malar, isipadu gas tetap adalah berkadar songsang dengan tekanan. Menurut Hukum Boyle, isoterma untuk gas adalah hiperbola, tetapi gas sahih mempunyai isoterma hiperbola hanya dalam had p menghampiri 0.
Hukum Boyle digunakan untuk meramalkan tekanan gas apabila isipadu berubah (atau sebaliknya).
Pernyataan Hukum Boyle:
pV = malar (n, T malar)
iaitu p ialah tekanan gas dan V ialah isipadu gas.
Graf data asal Boyle
Hubungkait antara tekanan dan isipadu pertama kali disedari oleh dua ahli sains amateur, Richard Towneley dan Henry Power. Boyle mengesahkan jumpaan mereka melalui ujikaji dan menerbitkan keputusannya. Menurut Robert Gunther dan pihak berkuasa lain, pembantu Boyle, Robert Hooke, yang membina perkakasan ujikaji. Hukum Boyle berasaskan ujikaji dengan udara, yang dia anggap sebagai cecair zarah ketika rehat, berada antara spring halimunan kecil. Pada ketika itu udara masih dianggap satu daripada empat unzur, tetapi Boyle tidak menolaknya. Kemungkinan minat Boyle adalah untuk memahami udara sebagai unsur penting kehidupan [4]; dia menerbitkan contoh. pertumbuhan tumbuhan tanpa udara [5]. Ahli fizik Perancis Edme Mariotte (1620-1684) menjumpai hukum yang sama bebas dari Boyle pada tahun 1676, tetapi Boyle telahpun menerbitkan mengenainya pada 1662, dengan itu hukum ini boleh, tidak sepatutnya, dirujuk sebagai Mariotte atau hukum Boyle-Mariotte. Kemudian (1687) dalam Philosophiæ Naturalis Principia Mathematica Newton menunjukkan secara mathematik bahawa sekiranya cecair elestik terdiri daripada jirim pada rehat, antaramana kuasa menolak menyongsang berkadar dengan jaraknya, isipadu akan menurut kadar dengan tekanan [6], tetapi treatise mathematik ini bukanlah penjelasan fizikal bagi hubungkait yang diperhatikan. Tetapi menggantikan teori statik, teori kinetik yang diperlukan, yang diberikan dua abad kemudian oleh Maxwell dan Boltzmann.
Tafsiran
Kaitan teori kinetik dan gas ideal
Hukum Boyle menyatakan bahawa pada suhu kekal bagi jisim tetap, tekanan mutlak dan isipadu gas berkadar secara menyongsang. Hukum ini juga boleh dinyatakan dalam bentuk berlainan sedikit, bahawa hasil tekanan dan isipadu mutlak kekal malar.
Kebanyakan gas bertindak seperti gas ideal pada tekanan dan suhu serdahana. Had teknologi pada abad ke 1600-an tidak mampu menghasilkan tekanan tinggi atau suhu rendah. Dengan itu, hukum ini tidak mungkin memiliki herotan pada masa diterbitkan. Ketika peningkatan dalam teknologi membenarkan tekanan lebih tinggi dan suhu lebih rendah, perbezaan natara kelakuan ideal gas mula menjadi jelas, dan kaitan antara suhu dan isipadu hanya boleh digambarkan dengan tepat menggunakan teori gas sebenar.[7] Perbezaan digambarkan sebagao faktor boleh dimampat ("compressibility factor").
Robert Boyle (dan Edme Maria) menghasilkan hukum ini semata-mata berasaskan ujikaji. Hukum ini juga boleh dihasilkan secara teori berasaskan anggapan kewujudan atom dan molekul dan andaian mengenai pergerakan dan perlanggaran elestik sempurna (lihat teori kinetik gas). Rumusan ini mendapat tentangan hebat dikalangan masyarakat sains pada masa itu, kerana ia dilihat semata-mata teori ciptaan bagi mana tidak terdapat bukti yang boleh dilihat langsung.
Daniel Bernoulli pada tahun 1738 telah menghasilkan hukum Boyle dengan menggunakan hukum pergerakan Newton dengan penggunaan pada tahap molekul. Ia kekal terbiar sehingga sekitar 1845, apabila John Waterston menerbitkan kertas kerja membina pada aturan utama teori kinetik; ini ditolak oleh Royal Society of England. Kerja berikutnya oleh James Prescott Joule, Rudolf Clausius dan terutamanya oleh Ludwig Boltzmann mengukuhkan kedudukan teori kinetik gas dan membawa perhatian kepada kedua-dua teori Bernoulli dan Waterston.[8]
Perdebatan antara penyokong Bertenaga ("Energetics") dan Atomik ("Atomism") mendorong kepada Boltzmann untuk menulis buku pada 1898, yang mendapat kritikan sehingga mendorongnya membunuh diri pada 1906.[8] Albert Einstein pada 1905 menunjukkan bagaimana teori kinetik diguna pakai bagi pergerakan Brownian bagi zarah tergantung-cecair, yang disahkan pada tahun 1908 oleh Jean Perrin.[8]
Persamaan
Persamaan mathematik bagi hukum Boyle adalah:
di mana:
p mewakili tekanan pada sistem.
k mewakili nilai malar mewakili tekanan dan isipadu sistem.
Selagi suhu kekal malar jumlah tenaga diberikan kepada sistem tekal sepanjang operasinya dan dengan itu, secara teori, nilai k akan kekal sekata. Bagaimanapun, disebabkan hasilan tekanan ketika kuasa dikenakan secara sudut tepat ("perpendicular") dan kemungkinannya perlanggaran dengan jirim lain melalui teori perlanggaran ("collision theory"), pemberian tenaga pada permukaan mungkin tidak selamanya malar bagi nilai k seperti itu, tetapi akan memiliki had apabila pembezaan ("[[differential calculus") nilai tersebut melalui masa.
Memaksa peningkatan isipadu V pada jumlah tetap gas, mengekalkan gas pada suhu diukur pada awalnya, tekanan p mesti menurun menyongsang. Sama juga, mengurangkan isipadu gas meningkatkan tekanan.
Hukum Boyle digunakan bagi menjangka hasil memperkenalkan perubahan, pada isipadu dan tekanan sahaja, kepada jumlah tetap gas. Isipadu sebelum dan selepas dan tekanan pada jumlah tetap gas, di mana suhu sebelum dan selepas kekal sama (penyejukan dan pemanasan akan diperlukan bagi memenuhi syarat ini), dikaitkan dengan persamaan:
Hukum Boyle, Hukum Charles, dan Hukum Gay-Lussac membentuk gabungan hukum gas. Ketiga-tiga hukum gas bersama gabungan dengan hukum Avogadro boleh secara umum dianggap hukum gas ideal.
Hukum Charles
Dari Wikipedia bahasa Indonesia, ensiklopedia bebas
Dalam termodinamika dan kimia fisik, hukum Charles adalah hukum gas ideal pada tekanan tetap yang menyatakan bahwapada tekanan tetap, volume gas ideal bermassa tertentu berbanding lurus terhadap temperaturnya (dalam Kelvin).
Secara matematis, hukum Charles dapat ditulis sebagai:V: volume gas (m3),
T: temperatur gas (K), dan
k: konstanta.
Hukum ini pertama kali dipublikasikan oleh Joseph Louis Gay-Lussac pada tahun 1802, namun dalam publikasi tersebut Gay-Lussac mengutip karya Jacques Charles dari sekitar tahun 1787 yang tidak dipublikasikan. Hal ini membuat hukum tersebut dinamai hukum Charles. Hukum Boyle, hukum Charles, dan hukum Gay-Lussac merupakan hukum gas gabungan. Ketiga hukum gas tersebut bersama dengan hukum Avogadro dapat digeneralisasikan oleh hukum gas ideal.

2 komentar:
errr???pening kepala...huhuhu
hehe :)
Posting Komentar